Prélèvements
-
Sang
Dans la mesure du possible, les prélèvements devraient :
- Etre effectués entre 07:00 et 09:00
- Avoir lieu à jeun, 12 heures après le dernier repas
- Avoir lieu avant toute intervention diagnostique ou thérapeutique
- Lors de surveillance de dosage de médicaments il faut tenir compte du pic plasmatique et du steady state
- Le moment de la prise de sang doit toujours être documenté sur la feuille de demandes d'ex
 amens
amens - Lors de perfusion ou de transfusion, les prélèvements doivent toujours être effectués dans le bras opposé
- Si les prélèvements doivent être effectués au niveau des cathéters, le cathéter doit être rincé avec de l'eau physiologique et les 5 premiers mL de sang doivent être éliminés
- Lors de prélèvements multiples, l'ordre de prélèvement préconisé est le suivant:
- Flacons pour hémoculture
- Tubes sans additif
- Tube pour la coagulation (si uniquement un tube pour la coagulation à prélever, piquer 2 tubes et jeter le premier)
- Autres tubes contenant des additifs
- Si vous demandez des analyses en chimie et en immunologie ou sérologie, veuillez prélever 2 tubes.
-
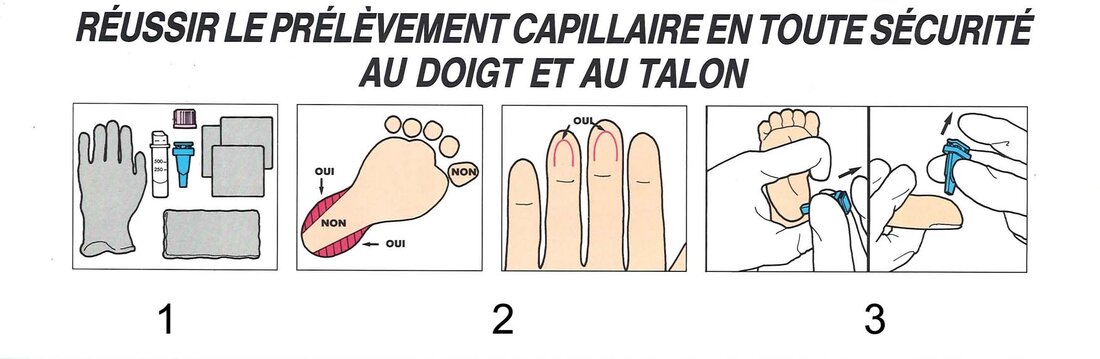
Sang capillaire
Le sang obtenu par prélèvement capillaire est composé d'un mélange de sang des artérioles, veinules et capillaires. Il peut également être dilué par du liquide interstitiel. La première goutte de sang capillaire devrait être éliminée. Le réchauffement du site de ponction artériolise le sang.
- Rassembler le matériel nécessaire et préparer le patient.
- Choisir le site de ponction, le réchauffer, le désinfecter et le sécher (voir ci-dessus des exemples de sites de ponction).
- Pratiquer l'incision : en maintenant fermement le talon ou le doigt, appuyer la lancette sur le site de ponction. Enfoncer le bouton-pressoir avec l'index et le relâcher immédiatement. Retirer la lancette et l'éliminer dans un conteneur.
-
Prélèvement chez les bébés
Sérum
Pour la chimie, l'immunologie ou la sérologie, en général, nous travaillons sur du sérum ou parfois du plasma. Chez un bébé qui a 50% d'hématocrite, on va récupérer au maximum 150 µLde sérum pour un microtube de 300 µL rempli jusqu'à la ligne.
Le volume mort dû au tube est de 50 µL; il va nous rester 100 µL pour les analyses.
Les analyses courantes de chimie nécessitent en moyenne 10 µL de sérum, les analyses immunochimiques elles, nécessitent en moyenne 20 µL et parfois jusqu'à 50 µL (TSH, PTH, allergène spécifique...).Hématologie
Avec 350 µL de sang EDTA nous pouvons effectuer une FSC + les réticulocytes ou un groupe + un test de Coombs.
Si vous avez des doutes, veuillez prendre contact avec le laboratoire.
-
Urine
Une urine doit répondre généralement à trois conditions afin que l'on puisse en retirer un maximum de renseignements :
- être concentrée : de ce fait, davantage d'éléments morphologiques pourront être vus à l'examen microscopique.
- être fraîche : le délai qui s'écoule entre l'émission des urines et l'examen permet une multiplication des germes contenus dans l'urine
- être acide : de ce fait, les protéines sont moins solubles, les éléments morphologiques, en particulier les cristaux et les cylindres vont moins se dissoudre
Différents types de prélèvements d'urine et leur utilité:
Spot urinaire Dosages qualitatifs et/ou quantitatifs Urine du milieu du jet Examen bactériologique 1ère urine du matin Constituants cellulaires, cylindres 2ème urine du matin (7 - 10 h) Dosages quantitatifs en relation avec le taux de créatinine si un recueil des urines de 24h est impossible Urines de 24 h Dosages quantitatifs Urines de 24 h
- Choisir l'agent conservateur* approprié (si nécessaire) et le mettre dans le flacon avant le début de la récolte
- Le matin, vider la vessie, jeter l'urine et noter le temps = Temps 0
- Récolter toutes les urines jusqu'au matin suivant. Conserver le(les) flacon(s) à 4°C entre les mictions.
- Le matin suivant, à la même heure que le jour précédent, Temps 24h, récolter la dernière portion d'urine
- Relever le volume de la diurèse sur la graduation du récipient
- Noter le volume et le temps de récolte sur la feuille de demande d'analyses
- Mélanger et aspirer dans le tube Vacutainer approprié. S'il y a des analyses spéciales, envoyer plusieurs tubes (voir remarques dans la liste des analyses).
- Coller sur le tube l'étiquette identifiant le patient.
*Les conservateurs servent à empêcher la dégradation des substances à analyser.
Récolte des urines de 24 h pour le dosage des composants les plus fréquemment analysés
Analyses pouvant être effectuées avec ou sans agent conservateur Analyses ne pouvant être effectuées qu'avec un agent conservateur Analyses à effectuer uniquement sans agent conservateur Aldostérone Acide 5-hydroxyindole acétique (5-HIAA)a Acide urique Calcium Acide homovanillique (HVA)a Albumine Chlorures (sauf HCl) Acide vanilmandélique (VMA)a Cortisol libre Citrates Catécholaminesa Protéines Créatinine Métanéphrinesa Glucose Magnésium Oxalates Phosphates (avec HCl si infection) Potassium Sodium Urée aAjout de citrate de sodium avant le début de la récolte
-
LCR
L'examen du LCR est une aide précieuse au diagnostic. L'obtention du LCR nécessite un geste invasif dont la répétition en raison d'un prélèvement insatisfaisant ou insuffisant est difficile à justifier. Avant d'effectuer ce geste il est extrêmement important de définir au préalable :
- quels examens vont être effectués
- la quantité de LCR à prélever et le nombre de tubes à préparer
Dans la mesure du possible, le LCR doit être prélevé avant toute antibiothérapie.
- Eliminer les 3 premières gouttes de LCR.
- Si possible prélever 3 tubes numérotés dans l'ordre de prélèvement (pour chimie, hématologie, microbiologie).
- Si des examens spéciaux sont demandés, prélever davantage de LCR et éventuellement du sérum (1).
(1) Pour de plus amples informations, veuillez consulter la liste des analyses.
-
Centrifugation
Serum/Plasma
Pour obtenir une bonne qualité de sérum, la centrifugation devrait être effectuée sur du sang coagulé. Le temps approximatif pour que le sang coagule dans le tube est d'environ 30 minutes.
Pour obtenir du sérum à partir de sang coagulé, la centrifugation devrait être effectuée pendant 10 à 15 minutes à :
Monovette Serum-Gel 2500 g Vacutainer SST II Advance 1300-2000 g Pour le plasma, la centrifugation devrait être effectuée à :
Monovette Li-Heparin-Gel 3000 g Vacutainer 1300-2000 g
Ce temps et ces vitesses de centrifugation sont d'autant plus importants lors de l'utilisation de tubes avec du gel séparateur.La vitesse de rotation à programmer sur la centrifugeuse (N) dépend du nombre de g nécessaires et de la distance entre l'axe de rotation et le tube (R).
Nombre de g = 1,118 x 10-5 x R x N2
Calculateur de centrifugation : http://www.sarstedt.com/php/main.php
-
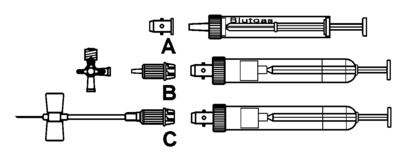
Les possibilités de combinaison
- Si l'on doit prélever du sang avec une seringue à cône «Luer» (par exemple Gaz sanguin) on peut utiliser l’adaptateur à membrane (A).
- A l'aide du Multi-Adaptateur (B) on peut utiliser les Monovettes® pour la prise de sang depuis des connections «Luer» (robinet à 3 voies, Butterfly, etc.).
- Pour la prise de sang avec un Butterfly, on utilise le «Multifly®» (C) avec un Multi-Adaptateur.
Système de prélèvement par aspiration
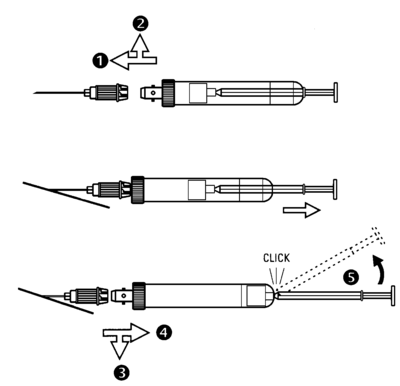
- Avant la prise de sang, l’aiguille pour la Monovette® est mise sur le cône à membrane de la Monovette®. Elle est fixée en la tournant légèrement dans le sens des aiguilles d'une montre, (1 + 2).
- Ponctionner la veine, libérer le garrot et retirer lentement la tige du piston. Attendre que le sang arrête de couler.
- Libérer la Monovette® en la tournant légèrement dans le sens des aiguilles d'une montre, (3 + 4). L’aiguille reste dans la veine.
- Lors de prélèvements multiples, introduire les Monovettes® suivantes dans l’aiguille couchée
Fin du processus de la prise de sang :
Libérer la dernière Monovette® de l’aiguille (3 + 4), retirer ensuite l’aiguille de la veine.
Important : D'ABORD LIBERER LA MONOVETTE® ET ENSUITE RETIRER L’AIGUILLE.- Mélanger soigneusement les prélèvements (ne pas secouer).
- Pour le transport et la centrifugation, le piston doit être verrouillé dans le fond de la Monovette®. La tige est ensuite cassée et jetée.
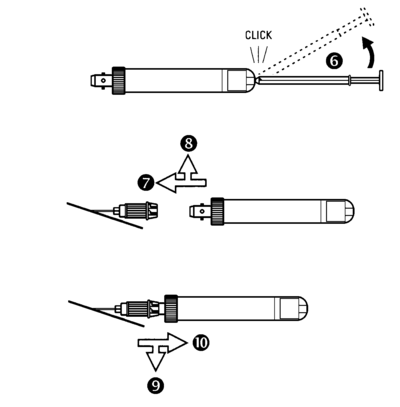
Système de prélèvement sous vide
Avant la prise de sang, l’aiguille doit déjà être dans la veine. La veine peut être pointée soit directement avec l’aiguille ou montée sur la Monovette® pour le premier prélèvement selon le principe d'aspiration, ensuite la technique sous vide peut être appliquée.
- Avant la prise de sang la tige du piston est retirée tout au fond de la Monovette®. Ensuite la tige du piston doit être cassée (6).
- Libérer le garrot, introduire et fixer la Monovette® dans l’aiguille en tournant légèrement dans le sens des aiguilles d'une montre (7 + 8).
- Attendre que le sang arrête de couler.
- Libérer la Monovette® en la tournant légèrement dans le sens des aiguilles d'une montre, (9 + 10). L’aiguille reste dans la veine.
- Lors de prélèvements multiples, introduire les Monovettes® suivantes dans l’aiguille couchée et prélever le sang comme décrit ci-dessus.
Fin du processus de la prise de sang :
Important : D'ABORD LIBERER LA MONOVETTE® ET ENSUITE RETIRER L’AIGUILLE.
- Libérer la dernière Monovette® de l’aiguille (3 + 4), retirer ensuite l’aiguille de la veine.
- Mélanger soigneusement les prélèvements (ne pas secouer).